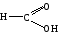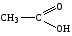План по теории для сдачи ОГЭ по химии (нужно знать обязательно).
-
Изменение свойств элементов в периодической системе (как изменяется Э.О, окисл и восстан., метал и неметалл. св-ва.)
-
Какие характеристики можно определить по номеру периода, по номеру группы.
-
Кто такой окислитель и восстановитель, как определить максимальную положительную и наименьшую отрицательную степень окисления. Какой элемент самый сильный окислитель
-
Типы хим связей и кристалл решеток.
-
Какие ме и как взаимодействуют с водой (см получение оксидов)
-
Какие металлы могут взаимодействовать с щелочами
-
С чем могут реагировать основные, амфотерные и кислотные оксиды. Как определить тип оксида
-
С чем могут реагировать основные и амфотерные гидроксиды. Как определить тип гидроксида.
-
С чем могут реагировать кислоты
-
С чем могут реагировать металлы
-
С чем могут реагировать неметаллы
-
Какие оксиды ме и неме взаимодействуют с водой (см хим св-ва оксидов)
-
Какие оксиды относят к несолеобразующим.
-
Взаимодействие кислотных и амфотерных оксидов с солями, правило.
-
Какие ме относят к щелоч. и щелочнозем. (см тему оксиды)
-
Какие ме реагируют с разбавлен кислотами. (тема кислоты)
-
Как получают в лаборатории кислород, как доказать наличие кислорода
-
Как получают в лаборатории водород, как доказать наличие водорода
-
Выуч. таблицу кислот (знать основ кислоты, их силу и название солей) (с. 68)
-
Как понять, кто окислитель, а кто восстановитель в реакции, и в соединении
-
Типы хим. элементов и какие соединения они образуют?
-
Когда образуется FeCl2 и FeCl3 (знать реакции, тема железо)
-
Как из одной соли получить другую соль (что добавить). Условия протекания обменных реакций, что такое обменные реакции, между какими классами веществ. Какие соли могут реагировать между собой. С чем только могут реагировать нерастворимые соли?
-
Что такое средние, кислые, основные соли, знать примеры.
-
Как реагируют соли с кислотами? Правило (тема кислоты)
-
Какие вещества относят к сильным и слабым электролитам.
-
Что можно узнать по порядковому номеру элемента. Принцип электронейтральности
-
Какие реакции относят к экзотермическим и эндотермическим.
-
Кислотно-основный характер оксидов и гидроксидов, образованных переходными металлами (тема оксиды и гидроксиды)
-
Какие вещества разлагаются при образовании (Н2СО3, Н2SO3, NH4OH, AgOH)
-
Как меняется основный и кислотный характер веществ в периодах и группах.
-
Взаимодействие металлов с концентрированной серной, азотной и разбавленной азотной кислотой
-
Взаимодействие неметаллов с концентрированной серной, азотной и разбавленной азотной кислотой
-
Какие ме пассивируются конц серной и азотной к-той
-
Типы реакций
-
Как реагируют с кислородом щелочные ме. (тема оксиды)
-
Разложение нитратов (правило)
-
Какие ионы могут одновременно существовать в растворе? Что это значит?
-
Знать основные степени окисления, которые проявляют элементы с 1 по 8 группу.
-
Основные сильные окислители и восстановители в неорганической химии
-
Окраски индикаторов в разных средах
-
Какие кислоты являются сильными
-
Отношение галогенов к кислороду.
-
Аммиак, с чем реагирует и кем является.
-
Бурый газ, свойства, реакция с водой и щелочами
-
Свойства солей аммония
-
Сернистый газ и серный ангидрид, свойства
-
Сероводород.
-
Углекислый и угарный газ, свойства.
-
Взаимодействие хлора со щелочами при нагревании и на холоде
-
Взаимодействие конц серной кислоты с галогенидами, получение газообразного хлороводорода
-
Перманганат калия в различных средах в реакциях ОВР
-
Дихромат (бихромат) и хромат калия в реакциях ОВР
-
Галогенводороды. Хлор. Кислородосодержащие кислоты хлора.
-
Свойства азота
-
Свойства фосфора
-
Свойства серы.
-
Свойства кислорода и водорода
-
Качественные реакции на ионы. Реакции обнаружения.
-
Алканы, краткая характеристика и свойства. Метан
-
Алкены, краткая характеристика и свойства. Этилен
-
Алкины, краткая характеристика и свойства. Ацетилен
-
Арены, краткая характеристика и свойства. Бензол
-
Спирты, краткая характеристика и свойства. Этиловый спирт и метанол
-
Карбоновые кислоты, краткая характеристика и свойства. Уксусная кислота
-
Аминокислоты, краткая характеристика и свойства. Глицин и аланин
-
Жиры, белки, углеводы
Дополнительные вопросы.
-
Взаимодействие солей меди и серебра, оксида и гидроксида меди и серебра с раствором аммиака, образование комплексных соединений.
-
Какими металлами является Be и Mg
-
Взаимодействие перманганата калия и оксида марганца (4) с соляной кислотой.
-
Взаимодействие железной окалины с соляной кислотой и конц серной кислотой.
-
Реакция CuCl2 и FeCl3 с KI, а также Fe2O3 и CuO с HI. (идет обмен и реакция ОВР)
-
Реакции диспропорционирования, между соединениями серы, железа, меди, хрома, углерода и т.д.
-
Образование слабого электролита при взаимодействии солей с сильными кислотами (без газа, осадка и воды)
-
Взаимодействие Si и SiO2 со щелочами, с HF.
-
Какие неметаллы реагируют с водородом, какие нет (не могут Si и Р)
-
Реакция Mg с оксидами CO2 и SiO2
-
Какие металлы могут реагировать с водородом (щелоч и щелочнозем)
-
Образование кислых солей фосфорной кислоты. Реакция металлов с фосфорной кислотой
-
Переход хроматов в дихроматы и наоборот. Качественные при этом признаки.
-
Что такое s,p,d,f – элементы
-
Взаимодействие амфотерных оксидов и гидроксидов с основными оксидами и гидроксидами
Ответы.
-
В периодах слева направо уменьшается радиус атома, нарастают окислительные и неметаллические свойства и электроотрицательность, соответственно, уменьшаются восстановительные и металлические свойства.
В группах сверху вниз нарастают восстановительные и металлические свойства, увеличивается радиус атома, соответственно, уменьшаются окислительные и неметаллические свойства и электроотрицательность
-
По номеру периода можно определить число энергетических уровней в элементе, по номеру группы – его высшую валентность и число электронов на внешнем уровне, также максимальную положительную степень окисления. Например, азот N, находится в пятой группе, его максимальная валентность V, число внешних электронов 5, если он отдаст все пять электронов с внешнего уровня, его максимальная степень окисления будет равна +5, также ему не хватает до завершения внешнего уровня взять 3 электрона, тогда его степень окисления будет равна -3, или отдать 5 электронов, тогда степень окисления будет +5
-
Окислитель – тот кто берет электроны, Восстановитель – тот кто отдает электроны. Окислитель берет электроны и восстанавливается тем самым (восстановление процесс принятия электронов). Восстановитель отдает электроны тем самым он окисляется (окисление процесс отдачи электрона) Легче запомнить кто такой окислитель и восстановитель а процессы характерные им имеют противоположные названия.
Окислители берут электроны и степень окисления их понижается засчет отрицательного заряда электронов, а восстановители отдают электроны и повышают свою степень окисления, так как они отдают минусы
Металлы – только восстановители, и имеют поэтому только положительные степени окисления, а неметаллы могут быть и окислителями и восстановителями, поэтому могут иметь как положительные та и отрицательные степени окисления, кроме фтора, так как фтор – только окислитель, и он самый сильный окислитель.
-
Виды химических связей:
Ковалентная связь
Ионная связь
Металлическая связь
Водородная связь
Ковалентная связь возникает при образовании общих электронных пар. Ковалентная связь возникает только у неметаллов и бывает 3-х видов: ковалентная неполярная, ковалентная полярная и ковалентная связь с донорно-акцепторным механизмом.
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковой электроотрицательностью (Э.О.), то есть между атомами одного химического элемента Cl2 H2 P N2
Ковалентная полярная связь возникает между атомами неметаллов с разной электроотрицательностью. HCl H2O BF3
Донорно-акцепторная связь присутствует в ионе аммония NH4+, СО, Н3О+
Ионная связь образуется между атомами металла и неметалла. Данный вид связи характерен для всех оксидов металлов (ZnO, Na2O, Fe2O3, CaO), для всех солей, так как там присутствуют связи «металл – неметалл» (CaCl2, NaF, CuSO4, Ag3PO4).
Металлическая связь характерна для всех простых металлов (K, Ba, Mn, Pb и т.д.)
Водородная связь в большинстве случаев образуется между молекулами, то есть, преимущественно, является межмолекулярной связью. Водородная связь – это связь, образующаяся между атомом водорода H одной молекулы и сильно электроотрицательным элементом другой молекулы. Водородная связь образуется между молекулами галогенводородов (HCl, HBr, HI), воды H2O, спиртов, минеральных и органических (карбоновых) кислот.
По виду частиц, которые существуют в веществе, кристаллическую решётку разделяют на 4 типа:
Атомная кристаллическая решётка
Ионная кристаллическая решётка
Металлическая кристаллическая решётка
Молекулярная кристаллическая решётка
Атомная кристаллическая решётка характерна для всех твердых веществ, состоящих из атомов: для всех оксидов металлов (FeO, ZnO) и твердых оксидов неметаллов (SiO2, P2O5), для твердых простых неметаллов (C, Si) и неметаллических соединений (SiC), и соединений металлов и неметаллов, не состоящих из ионов (CaC2, Na3P, Al4Si3). Например, алмаз является твердым веществом, образованным элементом углеродом C, также графит
Ионная кристаллическая решётка характерна для всех веществ, изначально состоящих из ионов. К ним относятся все соли и гидроксиды (FeCl2, K2SO4, Mg3(PO4)2, NaOH, Cu(OH)2), а также оксиды щелоч. и щелочно-земельных металлов (Na2O, CaO)
Металлическая кристаллическая решётка характерна для простых неметаллов (K, Na, Ba, Fe, Al, Pb).
Молекулярная кристаллическая решетка характерная для всех веществ, находящихся в жидком и газообразном состоянии при обычных условиях, поэтому все жидкости и газы состоят из молекул (за исключением жидких металлов, например, ртути Hg).
-
К веществам с молекулярной кристаллической решеткой относятся все газы (CO2, N2, H2, SO2, NH3, благородные газы He, Ne и т.д.), все неорганические кислоты, так как при обычных условиях они чаще всего являются жидкостями и газами (H2SO4, HCl, HNO3), все галогены (F2, Cl2, даже йод I2, хотя при обычных условиях йод является твердым веществом), некоторые твердые простые неметаллы (ромбическая сера S8, белый фосфор P4), все органические вещества в любом агрегатном состоянии (углеводороды, спирты, карбоновые кислоты, амины и т.д.) Вещества с молекулярной кристаллической решеткой обладают очень низкими температурами кипения и плавления.
-
Какие ме и как взаимодействуют с водой (см получение оксидов)
с водой реагируют при обычных условиях только щелочные и щелочноземельные металлы с образованием оснований, при этом еще Al и Mg, так как являются очень активными металлами
Na + H2O = NaOH + H2
Все остальные металлы стоящие в ряду напряжения до Н реагируют с водой при высокой температуре с образованием оксидов
Zn + H2O = ZnO + H2
Металлы после Н в ряду напряжения не реагируют с водой
-
Какие металлы могут взаимодействовать с щелочами
С щелочами и их растворами могут реагировать только переходные металлы, такие как Al, Zn, Be, Cr так как имеют двойственные свойства, способность реагировать как с кислотами, так и основаниями, но только с сильными кислотами и сильными основаниями
0 +1 -2 +1 +1 -2 +1 +2 -2 +1 0
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
0 +1 -2 +1 +1 -2 +1 +3 -2 +1 0
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
-
С чем могут реагировать основные, амфотерные и кислотные оксиды. Как определить тип оксида.
-
Оксиды делятся на 4 типа:
-
Основные оксиды – оксиды, образованные типичными металлами, а также переходными металлами в низших степенях окисления. Типичные металлы находятся в I, II группе главных подгруппах. Переходные металлы, в основном, заселяют все побочные подгруппы с I по VIII группу, также некоторые металлы главных подгрупп (Al, Ga), в основном, расположенные в нижней части групп (Pb, Sn, Bi). Основные оксиды, образованные типичными металлами – Na2O, CaO, MgO. Основные оксиды образуют переходные металлы в низших степенях окисления, поэтому данные металлы обязательно должны иметь несколько степеней окисления. К основным оксидам, образованным переходными металлами, относятся FeO, CrO, CuO, Cu2O, MnO.
-
Амфотерные оксиды – оксиды, образованные переходными металлами в единственных или промежуточных степенях окисления. Допустим, цинк Zn является переходным металлом, находится во II группе побочной подгруппе (главную подгруппу часто обозначают знаком «А», побочную подгруппу – знаком «Б»), поэтому его единственная валентность II, степень окисления +2 (так как цинк является металлом, поэтому только восстановитель). Исходя из этого, цинк образует амфотерный оксид ZnO. Марганец Mn находится в VII группе побочной подгруппе, имеет несколько валентностей и степеней окисления, его промежуточная степень окисления +4, соответственно, марганец в промежуточной степени окисления +4 образует амфотерный оксид MnO2. К амфотерным оксидам относятся Fe2O3, Cr2O3, Al2O3, ZnO, MnO2.
-
Кислотные оксиды – оксиды, образованные типичными неметаллами, а также переходными металлами в высших степенях окисления. Типичные неметаллы находятся в группах с III по VIII, главных подгруппах. К кислотным оксидам, образованным типичными неметаллами, относятся SO3, SO2, Cl2O7, N2O3, P2O5, CO2. Марганец Mn находится в VII группе побочной подгруппе, поэтому его высшая валентность равна VII, высшая степень окисления +7, соответственно, марганец в высшей степени окисления образует кислотный оксид Mn2O7. К кислотным оксидам, образованным переходными металлами, относятся CrO3, Mn2O7, MnO3.
-
Несолеобразующие оксиды – это оксиды, образованные неметаллами, но они не реагируют с водой с образованием кислот в отличие от кислотных оксидов, не вступают в кислотно-основное взаимодействие. К несолеобразующим оксидам относятся только 3 оксида: CO, NO, N2O.
Основные оксиды.
-
Химические свойства основных оксидов
-
Взаимодействие с водой
С водой при обычных условиях взаимодействуют только оксиды щелочных и щелочноземельных металлов. Щелочные металлы находятся в I группе главной подгруппе, щелочноземельные – находятся во II группе главной подгруппе (только Ca, Sr, Ba).
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
-
Взаимодействие с кислотными оксидами
Основные оксиды, как вещества основного характера, хорошо реагируют с веществами кислотного характера, то есть с кислотами и кислотными оксидами.
Li2O + CO2 = Li2CO3
MgO + N2O5 = Mg(NO3)2
-
Взаимодействие с кислотами
CuO + H2SO4 = CuSO4 + H2O
FeO + 2HCl = FeCl2 + H2O
-
Взаимодействие с амфотерными оксидами и гидроксидами
-
Взаимодействие с восстановителями (C, CO, NH3, H2)
Основные оксиды могут реагировать с сильными восстановителями при нагревании с образованием металлов. Это свойство используют для промышленного получения металлов из их оксидов:
+2 -2 0 t 0 +2 -2
FeO + C = Fe + CO
+2 -2 +2 -2 t 0 +4 -2
MnO + CO = Mn + CO2
+2 -2 0 t 0 +1 -2
CuO + H2 = Cu + H2O
+2 -2 -3 +1 t 0 0 +1 -2
3CuO + 2NH3 = 3Cu + N2 + 3H2O
-
Взаимодействие с металлами
При нагревании металлы могут реагировать с оксидами металлов, при этом только более активный металл может вытеснить менее активный из оксида. Активность металлов уменьшается слева направо в электрохимическом ряду напряжения металлов (рис. 20):
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H2, Cu, Hg, Ag, Au
Осслабление восстановительных свойств, химической активности.
Рис. 20. Электрохимический ряд напряжения металлов.
Таким образом, металл, стоящий в ряду напряжения левее, может вытеснить металл, стоящий правее в ряду напряжения.
+2 -2 0 t 0 +1 -2
MgO + 2Li = Mg + Li2O
+2 -2 0 t 0 +2 -2
CuO + Mn = Cu + MnO
-
Химические свойства амфотерных оксидов
-
Амфотерные оксиды, в отличие от основных, не взаимодействуют с водой
-
Взаимодействие с основными оксидами и гидроксидами
-
Взаимодействие с кислотными оксидами
Амфотерные оксиды проявляют слабые основные свойства, поэтому взаимодействуют только с кислотными оксидами, образующими сильные кислоты:
Fe2O3 + 3SO3 = Fe2(SO4)3
Al2O3 + 3N2O5 = 2Al(NO3)3
-
Взаимодействие с кислотами
Амфотерные оксиды проявляют слабые основные свойства, поэтому взаимодействуют только с сильными кислотами:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
-
Взаимодействие с металлами
+3 -2 0 t +3 -2 0
Cr2O3 + 2Al = Al2O3 + 2Cr
В данной реакции алюминий Al как более активный металл вытесняет менее активный хром Cr.
-
Взаимодействие с сильными восстановителями
+2 -2 +2 -2 t 0 +4 -2
ZnO + CO = Zn + CO2
В данной реакции восстановителем является угарный газ СО (углерод С+2 как восстановитель отдает 2ē и повышает степень окисления с +2 до +4), а оксид цинка является окислителем (цинк Zn+2 как окислитель принимает 2ē и понижает степень окисления с +2 до 0).
-
Взаимодействие с солями
Амфотерные оксиды, проявляя свойства кислотных оксидов, могут реагировать с кислородосодержащими солями, при этом вытесняя более летучий кислотный оксид из соли:
t
CaCO3 + ZnO = CaZnO2 + CO2↑
-
Химические свойства кислотных оксидов
-
Взаимодействие с водой
Все кислотные оксиды взаимодействуют с водой с образованием кислот, кроме оксида кремния SiO2 (он не растворяется в воде, и соответствующая ему кремниевая кислота H2SiO3 также в воде не растворима).
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
-
Взаимодействие с основными оксидами
N2O5 + Na2O = 2NaNO3
CO2 + CaO = CaCO3
-
Взаимодействие с амфотерными оксидами
SO3 + ZnO = ZnSO4
Al2O3 + 3Cl2O7 = 2Al(ClO4)3
-
Взаимодействие с основными гидроксидами
CO2 + 2KOH = K2CO3 + H2O
-
Взаимодействие с амфотерными гидроксидами
3SO3 + 2Fe(OH)3 = Fe2(SO4)3 + 3H2O
-
Взаимодействие с солями
Кислотные оксиды способны реагировать с кислородосодержащими солями, при этом только менее летучий оксид (твердый оксид) может вытеснить более летучий оксид (газообразный, жидкий или твердый).
t
CaCO3 + SiO2 = CaSiO3 + CO2↑
В данной реакции твердый оксид кремния SiO2 вытесняет из соли углекислый газ CO2.
t
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5
В данной реакции твердый оксид кремния SiO2 вытесняет из соли также твердый оксид фосфора P2O5, так как является менее летучим (то есть имеющим более высокие температуры плавления и кипения в отличие от оксида фосфора P2O5).
-
С чем могут реагировать основные и амфотерные гидроксиды. Как определить тип гидроксида.
-
Гидроксиды делятся на 2 типа:
-
Основные гидроксиды (основания) – это гидроксиды, образованные типичными металлами, а также переходными металлами в низших степенях окисления. К ним относятся NaOH, Ca(OH)2, Fe(OH)2, Cu(OH)2, Mg(OH)2, Cr(OH)2, Mn(OH)2.
-
Амфотерные гидроксиды – это гидроксиды, образованные переходными металлами в единственных или промежуточных степенях окисления. К ним относятся Zn(OH)2, Al(OH)3, Fe(OH)3, Cr(OH)3.
-
Химические свойства основных гидроксидов
-
Взаимодействие с кислотными оксидами
2NaOH + SO2 = Na2SO3 + H2O
Fe(OH)2 + N2O5 = Fe(NO3)2 + H2O
-
Взаимодействие с амфотерными оксидами и гидроксидами
Когда вещества находятся в растворенном состоянии (в растворе), то образуется комплексная соль при обычных условиях:
NaOH(р-р) + Al(OH)3 (р-р) = Na[Al(OH)4]
3NaOH(р-р) + Al(OH)3 (р-р) = Na3[Al(OH)6]
-
Взаимодействие с кислотами
Cr(OH)2 + H2SO4 = CrSO4 + 2H2O
LiOH + HCl = LiCl + H2O
-
Взаимодействие с растворимыми солями, с образованием нерастворимых гидроксидов
CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl
Данная реакция является обменной, поэтому в ходе реакции должно выполняться одно из условий протекания ионного обмена. В данном случае здесь возможно образование только нерастворимого гидроксида.
-
Разложение нерастворимых оснований
t
Mg(OH)2 = MgO + H2O
-
Химические свойства амфотерных гидроксидов
-
Взаимодействие с кислотными оксидами
Zn(OH)2 + SO3 = ZnSO4 + H2O
-
Взаимодействие с основными оксидами и гидроксидами
-
2NaOH(р-р) + Zn(OH)2 (р-р) = Na2[Zn(OH)4]
-
Взаимодействие с кислотами
Cr(OH)3 + 3HBr = CrBr3 + 3H2O
-
Разложение при прокаливании (нагревании)
Все амфотерные гидроксиды не растворяются в воде, поэтому при прокаливании будут разлагаться на амфотерный оксид и воду.
t
2Cr(OH)3 = Cr2O3 + 3H2O
-
С чем могут реагировать кислоты
-
Химические свойства кислот
-
Взаимодействие с металлами
Все растворы кислот (разбавленные кислоты) реагируют с металлами с образованием газа водорода H2, при этом реакция возможна только с металлами, стоящими в ряду напряжения до водорода H. Разбавленная азотная кислота HNO3 никогда не выделяет водород H2, так как является в отличие от других разбавленных кислот сильным окислителем.
+1 +6 -2 0 +2 +6 -2 0
H2SO4 + Sn = SnSO4 + H2↑
+1 -1 0 +2 -1 0
2HCl + Zn = ZnCl2 + H2↑
-
Взаимодействие с основными и амфотерными оксидами
2HI + MnO = MnI2 + H2O
H2SO4 + Na2O = Na2SO4 + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
-
Взаимодействие с основными и амфотерными гидроксидами
2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6H2O
HCl + KOH = KCl + H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
3HBr + Cr(OH)3 = CrBr3 + 3H2O
Реакции взаимодействия кислот с гидроксидами с образованием соли и воды называются реакциями нейтрализации.
-
Взаимодействие с солями
Кислоты реагируют с солями при условии, что более сильная кислота вытесняет более слабую, при этом должно обязательно выполняться одно из условий протекания обменных реакций: выделения газа, осадка (малодиссоциирующего вещества) или воды. Первое условие может нарушаться, если выполняется второе условие (условие протекание обменных реакций)
2HCl + CaCO3 = CaCl2 + H2CO3
СО2↑ Н2О
HCl + AgNO3 = AgCl↓ + HNO3
В последней реакции нарушается правило о том, что более сильная кислота вытесняет более слабую, но при этом выполняется условие протекания обменных реакций – выпадение осадка, нерастворимого в кислотах, поэтому реакция идет.
-
Разложение некоторых слабых кислот при нагревании
При нагревании способны разлагаться такие слабые кислоты, как H2SiO3, H2CO3, H2SO3
t
H2SiO3 = SiO2↓ + H2O
t
H2SO3 = SO2↑ + H2O
-
С чем могут реагировать металлы
-
Взаимодействие с простыми веществами
-
Взаимодействие с неметаллами
Все металлы способны взаимодействовать с неметаллами, так как все неметаллы способны проявлять окислительные свойства. Активные металлы (щелочные и щелочноземельные) с активными неметаллами реагируют легко, при обычных условиях. Менее активные металлы (переходные металлы) с малоактивными неметаллами реагируют хуже, чаще при нагревании:
0 0 +1 -1
2Na + Cl2 = 2NaCl
0 0 +2 -2
Ca + S = CaS
0 0 t +3 -4
4Al + 3C = Al4C3
-
Взаимодействие с кислородом
Большинство металлов при взаимодействии с кислородом образуют оксиды:
0 0 +2 -2
2Zn + O2 = 2ZnO
0 0 +3 -2
4Al + 3O2 = 2Al2O3
Щелочные металлы в отличие от всех остальных металлов при взаимодействии с кислородом образуют сначала пероксиды или перекиси, в которых кислород проявляет степень окисления -1. Исключением является литий Li, он как и большинство металлов с кислородом сразу образует оксид.
0 0 +1 -1
2Na + O2 = Na2O2
0 0 +1 -2
4Li + O2 = 2Li2O
Пероксиды переходят в оксиды при действии на них избытка металла:
+1 -1 0 +1 -2
Na2O2 + 2Na = 2Na2O
3) Взаимодействие с водородом
Активные металлы (щелочные и щелочноземельные) способны при нагревании реагировать с водородом, образуя гидриды (обратите внимание, что в данном случае водород является окислителем, хотя по своей природе он сильный восстановитель):
0 0 +1 -1
2Li + H2 = 2LiH
Гидриды являются довольно неустойчивыми соединениями, легко взаимодействуют с водой:
+1 -1 +1 -2 +1 -2 +1 0
LiH + H2O = LiOH + H2↑
2. Взаимодействие со сложными веществами.
1) Взаимодействие с водой
Щелочные и щелочноземельные металлы (в том числе и Al) взаимодействуют с водой легко и при обычных условиях с образованием соответствующего гидроксида и газа водорода:
0 +1 -2 +1 -2 +1 0
2K + 2H2O = 2KOH + H2↑
0 +1 -2 +3 -2 +1 0
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Переходные металлы взаимодействуют с водой только при высокой температуре с образованием оксида и газа водорода, при этом металл должен стоять в ряду напряжения до водорода, то есть он должен быть более активным по восстановительной способности, чем водород.
0 +1 -2 t +2 -2 0
Zn + H2O = ZnO + H2↑
t
Cu + H2O = реакция не идет
(Cu стоит в ряду напряжения металлов после водорода).
2) Взаимодействие с кислотами
0 +1 -1 +3 -1 0
2Al + 6HCl = 2AlCl3 + 3H2↑
Ag + HCl = реакция не идет
(Ag стоит в ряду напряжения после водорода)
В реакциях металлов с концентрированными кислотами не действует правило для разбавленных кислот, так как в них не происходит выделение газа водорода Н2.
0 +1 +6 -2 +2 +6 -2 +4 -2 +1 -2
Pb + 2H2SO4(конц) = PbSO4 + SO2↑ + 2H2O
С разбавленными кислотами реагируют металлы, стоящие в ряду напряжения до водорода, с образованием соли и газа водорода.
Щелочные металлы не реагируют с разбавленными кислотами, так как они очень активно реагируют с водой, поэтому они, попадая в водный раствор кислот, будут реагировать, в первую очередь, не с кислотой, а с водой.
3) Взаимодействие с оксидами металлов
Металлы реагируют с оксидами металлов при нагревании, при этом только более активный металл может вытеснить менее активный из оксида, активность определяется по ряду напряжения металлов. Определенный металл может вытеснить из оксида все металлы, стоящие после него в ряду напряжения.
0 +2 -2 t +3 -2 0
2Al + 3ZnO = Al2O3 + 3Zn
Pb + ZnO = реакция не идет
(Pb стоит в ряду напряжения металлов после Zn)
4) Взаимодействие с солями
Металлы вступают в реакции с солями при нагревании точно по такому же принципу, как и с оксидами металлов.
0 +2 -1 t +2 -1 0
Zn + FeCl2 = ZnCl2 + Fe
Cu + FeCl2 = реакция не идет
(Cu стоит в ряду напряжения металлов после Fe)
5) Взаимодействие с кислотными оксидами
В некоторых случаях металлы способны вступать в реакцию с оксидами неметаллов, которые способны проявлять окислительные свойства.
0 +4 -2 t +2 -2 +2 -2
Mg + CO2 = MgO + CO
В данной реакции магний Mg является восстановителем, а углекислый газ СО2 является окислителем.
-
С чем могут реагировать неметаллы
1. Взаимодействие с простыми веществами.
1) Взаимодействие с металлами
Так как неметаллы могут являться окислителями, то они реагируют с металлами – типичными восстановителями.
0 0 +2 -1
Ca + F2 = CaF2
0 0 +2 -1
2K + S = K2S
2) Взаимодействие с неметаллами
Благодаря тому, что неметаллы могут быть и окислителями, и восстановителями, то они могут реагировать друг с другом, при этом, естественно, один из них будет окислителем, другой – восстановителем. Окислителем будет именно тот неметалл, который имеет большее значение электроотрицательности.
0 0 +2 -1
S + Cl2 = SCl2
0 0 +5 -2
4P + 5O2 = 2P2O5
0 0 -3 +1
N2 +3H2 = 2NH3
-
Взаимодействие со сложными веществами.
1) Взаимодействие с растворами щелочей
Большинство неметаллов реагирует при обычных условиях или при нагревании с растворами щелочей, при этом проявляя себя одновременно как окислитель и восстановитель (такие реакции называют реакциями диспропорционирования):
0 +1 -2 +1 t +1 -2 +1 +4 -2 +1 -2
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
0 +1 -2 +1 t +1 -1 +1 +5 -2 +1 -2
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
2) Взаимодействие с водой
Некоторые неметаллы способны реагировать с водой, также выступая в роли окислителя и восстановителя:
0 +1 -2 +1 -1 +1 +1 -2
Cl2 + H2O = HCl + HClO
3) Взаимодействие с концентрированными кислотами
Большинство неметаллов способны растворяться в кислотах, проявляющих сильные окислительные свойства (концентрированные азотная и серная кислоты, разбавленная азотная кислота). При этом из неметаллов образуются соответствующие кислоты:
0 +1 +5 -2 +1 +6 -2 +2 -2
S + 2HNO3(разб) = H2SO4 + 2NO↑
0 +1 +6 -2 +1 +5 -2 +2 -2 +1 -2
2P + 5H2SO4(конц) = 2H3PO4 + 5SO2↑+ 2H2O
4) Взаимодействие с солями
Неметаллы способны реагировать с бескислородными солями, при этом более активный неметалл (более сильный окислитель) вытесняет из соли менее активный неметалл.
+1 -2 0 +1 -1 0
K2S + Cl2 = 2KCl + S↓
Взаимодействие неметаллов с солями бывает не только в виде реакций замещения, но и соединения.
+2 -1 0 t +3 -1
2FeCl2 + Cl2 = 2FeCl3
+1 -2 0 t +1 +6 -2
K2S + 2O2 = K2SO4
-
Какие оксиды ме и неме взаимодействуют с водой (см хим св-ва оксидов)
С водой реагируют только оксиды щелочных и щелочнозем металлов
СаО + Н2О = Са(ОН)2
Все кислотные оксиды реагируют с водой с образованием кислот, за искл оксида кремния SiO2, так как он не растворим в воде
SO3 + H2O = H2SO4
-
Какие оксиды относят к несолеобразующим – CO, N2O, NO, SiO
-
Взаимодействие кислотных и амфотерных оксидов с солями, правило.
Кислотные оксиды способны реагировать с кислородосодержащими солями, при этом только менее летучий оксид (твердый оксид) может вытеснить более летучий оксид (газообразный, жидкий или твердый).
t
CaCO3 + SiO2 = CaSiO3 + CO2↑
Амфотерные оксиды, проявляя свойства кислотных оксидов, могут реагировать с кислородосодержащими солями, при этом вытесняя более летучий кислотный оксид из соли:
t
CaCO3 + ZnO = CaZnO2 + CO2↑
-
Какие ме относят к щелоч. и щелочнозем.
Щелочные – металлы 1 группы главной подгруппы (все)
Щелочноземельные – только Ca, Sr, Ba
-
Какие ме реагируют с разбавлен кислотами.
Реагируют только с металлами в ряду напряжения до Н
-
Как получают в лаборатории кислород, как доказать наличие кислорода
В лаборатории получают кислород разложением перманганата калия, при этом собирают кислород в колбу или пробирку, наличие кислорода доказывают тлеющей лучиной, которая при контакте с кислородом вспыхивает.
+1 +7 -2 t +1 +6 -2 +4 -2 0
2KMnO4 = K2MnO4 + MnO2 + O2↑
-
Как получают в лаборатории водород, как доказать наличие водорода
0 +1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2↑
0 +1 -2 +1 -2 +1 0
2Na + 2H2O = 2NaOH + H2↑
Наличие водорода доказывают поднесением пламени спиртовки к колбе или пробирке с водородом, при этом водород сгорает с небольшим взрывом в виде хлопка.
-
Выуч. таблицу кислот (знать основ кислоты, их силу и название солей)
|
№ |
Название кислоты |
Формула |
Кислотный остаток |
Соответствую-щий оксид*(1) |
Название соли*(2) |
Сила кислоты |
|
1 |
Угольная |
H2CO3 |
CO32- |
CO2 |
Карбонаты |
Слабая |
|
2 |
Кремниевая |
H2SiO3 |
SiO32- |
SiO2 |
Силикаты |
Слабая |
|
3 |
Азотная |
HNO3 |
NO3- |
N2O5 |
Нитраты |
Сильная |
|
4 |
Азотистая |
HNO2 |
NO2- |
N2O3 |
Нитриты |
Слабая |
|
5 |
Фосфорная (ортофосфорная) |
H3PO4 |
PO43- |
P2O5 |
Фосфаты |
Средняя |
|
6 |
Метафосфорная |
HPO3 |
PO3- |
P2O5 |
Метафосфаты |
Слабая |
|
7 |
Серная |
H2SO4 |
SO42- |
SO3 |
Сульфаты |
Сильная |
|
8 |
Сернистая |
H2SO3 |
SO32- |
SO2 |
Сульфиты |
Слабая |
|
9 |
Сероводородная |
H2S |
S2- |
- |
Сульфиды |
Слабая |
|
10 |
Хромовая |
H2CrO4 |
CrO42- |
CrO3 |
Хроматы |
Сильная |
|
11 |
Дихромовая (бихромовая) |
H2Cr2O7 |
Cr2O72- |
CrO3 |
Бихроматы (дихроматы) |
Сильная |
|
12 |
Фтороводородная (плавиковая) |
HF |
F- |
- |
Фториды |
Слабая |
|
13 |
Хлороводородная (соляная) |
HCl |
Cl- |
- |
Хлориды |
Сильная |
|
14 |
Бромоводородная |
HBr |
Br- |
- |
Бромиды |
Сильная |
|
15 |
Йодоводородная |
HI |
I- |
- |
Йодиды |
Сильная |
|
16 |
Марганцевая |
HMnO4 |
MnO4- |
Mn2O7 |
Перманганаты |
Сильная |
|
17 |
Синильная |
HCN |
CN- |
- |
Цианиды |
Слабая |
|
18 |
Уксусная |
CH3COOH |
CH3COO- |
- |
Ацетаты |
Слабая |
|
*(1) – соответствующий оксид – тот оксид, из которого возможно образование данной кислоты, например, при взаимодействии с водой: N2O5 + H2O = 2HNO3, таким образом, кислоте HNO3 соответствует оксид N2O5. |
||||||
|
*(2) – каждая кислота образует соли, например, кислота HCl может образовать соль NaCl, название которой «хлорид натрия», BaCl2 – хлорид бария и т.д. |
-
Как понять, кто окислитель, а кто восстановитель в реакции, и в соединении
Если взять реакцию натрия и хлора, то мы знаем, что металлы – только восстановители, поэтому будут повышать степень окисления и в хим формуле металл поэтому всегда стоит на первом месте, так как он восстановитель, а хлор как неметалл будет окислителем, будет понижать степень окисления, и стоять на втором месте как окислитель в бинарном соединении.
0 0 +1 -1
2Na + Cl2 = 2NaCl
Na – 1ē Na+1
2Cl + 2ē 2Cl-1
Если взять реакцию между серой и хлором, то сера стоит перед хлором в периодической системе, а это значит, что хлор более сильный окислитель, чем сера, поэтому в реакции между ними хлор будет окислителем, и в формуле будет стоять на втором месте, а сера будет восстановителем, займет первое место в формуле.
0 0 +2 -1
S + Cl2 = SCl2
-
Типы хим. элементов и какие соединения они образуют?
Все элементы делятся на 3 типа: типичные металлы (I, II группа главная подгруппа кроме Be), переходные металлы (все побочные подгруппы включая Be и Al), типичные неметаллы (IV-VIII группа главная подгруппа включая B (бор)). Типичные металлы, а также переходные металлы в низших степенях окисления (Fe2+, Cr2+, Mn2+, Pb2+), а также Cu и Ag, все они образуют основные оксиды и гидроксиды (основания), переходные металлы в единственных и промежуточных степенях окисления (Cr3+, Mn4+, Fe3+) образуют амфотерные оксиды и гидроксиды, а типичные неметаллы, а также переходные металлы в высших степенях окисления (Cr6+, Mn5+, Mn6+) образуют кислотные оксиды и кислоты.
-
Когда образуется FeCl2 и FeCl3 (знать реакции, тема железо)
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
-
Как из одной соли получить другую соль (что добавить). Условия протекания обмен реакций, что такое обмен реакции, между какими классами веществ. Какие соли могут реагировать между собой. С чем только могут реагировать нерастворимые соли?
Чтобы из одной соли получить другую соль, часто необходимо добавить другую соль, или кислоту, основание, но так, чтобы выполнялось условие протекания обмен реакций – газ осадок вода или слабый электролит
Нужно получить NaNO3 из NaCl
NaCl + AgNO3 = NaNO3 + AgCl↓
Обмен реакции протекают между солями кислотами и гидроксидами
2 соли могут реагировать между собой только если они обе растворимые иначе они не смогут обмениваться ионами так как не смогут распадаться на них.
Нерастворимые соли могут раствориться только в сильных кислотах.
-
Что такое средние, кислые, основные соли, знать примеры.
Средние NaCl, K2CO3
Кислые NaHSO3
Основные CuOHCl
-
Как реагируют соли с кислотами? Правило (тема кислоты)
Только сильная кислота может вытеснить из соли более слабую кислоту
Na2CO3 + HCl = NaCl + CO2 + H2O
Это правило может нарушаться только если будет обязательно выполняться условие протекание реакций ионного обмена
Ba(NO3)2 + H2SO4 = BaSO4↓ + HNO3
-
Какие вещества относят к сильным и слабым электролитам.
К сильным электролитам (электролитам) относятся все растворимые соли, сильные кислоты и сильные основания (гидроксиды щелочных и щелочноземельных металлов).
К слабым электролитам (неэлектролитам) относятся все нерастворимые соли, слабые кислоты и нерастворимые гидроксиды.
К неэлектролитам также относятся все вещества, не состоящие из ионов: все простые вещества, все оксиды, неметаллические вещества (состоящие из двух неметаллов), все органические вещества (за исключением растворимых солей, образованных аминами и карбоновыми кислотами).
-
Что можно узнать по порядковому номеру элемента. Принцип электронейтральности
Порядковый номер элемента равен заряду ядра со знаком +, так как ядро положительно заряжено, Порядковый номер элемента равен также числу протонов, числу электронов (число протонов совпадает с числом электронов в атоме – принцип электронейтральности, заряд протона +1, а электрона -1, таким образом суммарный положительный заряд протонов равен суммарному отрицательному заряду электронов, в итоге заряд атома равен 0). Если из атомной массы вычесть порядковый номер, получаем число нейтронов.
-
Какие реакции относят к экзотермическим и эндотермическим.
Экзотермические реакции – реакции, протекающие с выделением энергии.
Эндотермические реакции – реакции, протекающие с поглощением энергии.
К экзотермическим реакциям относятся все реакции горения органических веществ, все реакции соединения, реакции замещения щелочных и щелочноземельных металлов с водой, все реакции металлов с кислотами, реакции обмена между кислотами и гидроксидами, кислотами и солями. К эндотермическим реакциям относятся все реакции разложения.
-
Кислотно-основный характер оксидов и гидроксидов, образованных переходными металлами (тема оксиды и гидроксиды)
Если амфотерный металл имеет несколько степеней окисления то
В низших степенях окисления он образует основной оксид в промежуточных амфотерные оксиды в высших степенях окисления кислотные оксиды
CrO MnO FeO - основные
Cr2O3 MnO2 Fe2O3 амфотерные
CrO3 MnO3 Mn2O7 кислотные
-
Какие вещества разлагаются при образовании (Н2СО3, Н2SO3, NH4OH, AgOH)
Na2SO3 + 2HCl = 2NaCl + H2SO3
H2O SO2↑
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
CaCO3 + H2SO4 = CaSO4 + CO2↑ + H2O
2AgNO3 + 2KOH = 2KNO3 + Ag2O↓ + H2O
-
Как меняется основный и кислотный характер веществ в периодах и группах.
В группах сверху вниз как правило усиляется кислотный характер безкислородных кислот, так например в ряду HF- HCl – HBr – HI самая сильная йодоводородная кислота, HF – слабая, и ослабевает сила кислородосодержащих кислот и кислотных оксидов, так например H2CO3 более сильная, чем H2SiO3.
В группах сверху вниз основные свойства оксидов и гидроксидов растут
В периодах слева направо ослабевают основные свойства. И нарастают кислотные свойства всегда.
-
Взаимодействие металлов с концентрированной серной, азотной и разбавленной азотной кислотой
В отличие от разбавленной серной кислоты, H2SO4(к) является сильным окислителем, и при взаимодействии с металлами никогда не выделяет водород (Рис. 1). Азотная разбавленная и концентрированная кислоты также являются сильными окислителями и никогда не выделяют Н2.
-2
Соль +H2S↑ + H2O
Ме в ряду напряжения стоит до Al
0
Ме в ряду напряжения стоит от Al до Н
+6
Соль +S↓ (SO2) + H2O
H2SO4(к)+ Ме
+4
Соль +SO2↑ + H2O
Ме в ряду напряжения стоит после Н
+1 +6 -2 0 +2 +6 -2 +1 -2 +1 -2
5H2SO4(к) + 4Ca = 4CaSO4 + H2S + 4H2O
+1 +6 -2 0 +2 +6 -2 0 +1 -2
4H2SO4(к) + 3Zn = 3ZnSO4 + S + 4H2O
+1 +6 -2 0 +2 +6 -2 +4 -2 +1 -2
2H2SO4(к) + Cu = CuSO4 + SO2 + 2H2O
Соль + NH3↑(NH4NO3) + H2O
Ме стоит в ряду напряжения до Al
+5
+2
Соль + NO↑ + H2O
Ме стоит в ряду напряжения после Al вкл.
HNO3+ Me
+1 +5 -2 0 +2 +5 -2 -3 +1 +1 -2
9HNO3 + 4Ca = 4Ca(NO3)2 + NH3↑ + 3H2O
+1 +5 -2 0 +2 +5 -2 +2 -2 +1 -2
8HNO3 + 3Mn = 3Mn(NO3)2 + 2NO↑ + 4H2O
Соль + N2O↑ + H2O
Ме стоит в ряду напряжения до Al
+5
+4
Соль + NO2↑ + H2O
Ме стоит в ряду напряжения после Al вкл.
HNO3(к)+ Me
+1 +5 -2 0 +2 +5 -2 +1 -2 +1 -2
10HNO3 + 4Ba = 4Ba(NO3)2 + N2O↑ + 5H2O
+1 +5 -2 0 +2 +5 -2 +4 -2 +1 -2
4HNO3 + Zn = Zn(NO3)2 + 2NO2↑ + 2H2O
-
Взаимодействие неметаллов с концентрированной серной, азотной и разбавленной азотной кислотой
Реакции H2SO4(к) с неметаллами протекает по следующим схемам:
H2SO4(к) + Неме = Кислота + SO2↑ + H2O
Или,
H2SO4(к) + Неме + H2O = Кислота + SO2↑
При взаимодействии разбавленной азотной кислоты HNO3 с неметаллами, как правило, образуется соответствующая для неметалла кислородосодержащая кислота, оксид азота NO, также возможно образование воды:
0 +1 +5 -2 +1 +6 -2 +2 -2
S + 2HNO3 = H2SO4 + 2NO↑
0 +1 +5 -2 +1 -2 +1 +5 -2 +2 -2
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
При взаимодействии концентрированной азотной кислоты HNO3 с неметаллами, как правило, образуется соответствующая для неметалла кислородосодержащая кислота, оксид азота NO2, также возможно образование воды:
0 +1 +5 -2 +1 +6 -2 +4 -2 +1 -2
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O
0 +1 +5 -2 +1 +5 -2 +4 -2 +1 -2
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
-
Какие ме пассивируются конц серной и азотной к-той (см тему азот и сера) – Al, Cr, Fe. С этими металлами реакция с концентрированными кислотами при обычных условиях не идет, идет только при нагревании.
-
Типы реакций
Все химические реакции по характеру протекания делятся на несколько типов:
-
реакции соединения
-
реакции разложения
-
реакции замещения
-
реакции обмена
-
Реакция соединения – это реакция, при которой два или несколько простых или сложных веществ соединяются в одно сложное или более сложное вещество:
N2 + 3H2 = 2NH3
CaO + CO2 = CaCO3
-
Реакция разложения – это реакция, при которой одно сложное вещество разлагается на два или несколько простых или менее сложных веществ.
t
Fe(OH)2 = FeO + H2O (буква t означает, что реакция протекает при нагревании)
t
CH4 = C + 2H2
-
Реакция замещения – это реакция, при которой атомы одного элемента или группа атомов вытесняет (замещает) атомы другого элемента или группу атомов.
Zn + 2HCl = ZnCl2 + H2
В данной реакции атом цинка Zn вытесняет (замещает) атомы водорода H.
t
CaCO3 + SiO2 = CaSiO3 + CO2
В данной реакции группа атомов элементов Si и О, а именно, оксид кремния SiO2 вытесняет (замещает) группу атомов элементов С и О, а именно, оксид углерода СО2.
-
Реакция обмена – это реакция, при которой два сложных вещества обмениваются ионами. Реакции обмена еще называют реакциями ионного обмена, так как в неё вступают только вещества, состоящие из ионов или способные распадаться на ионы, и обмен, соответственно, происходит ионами.
В реакции ионного обмена могут вступать только гидроксиды, кислоты и соли. Также оксиды с кислотами тоже стали относить к реакциям обмена
Гидроксиды, соли и кислоты способны распадаться на ионы. Эти классы веществ будут подробно рассмотрены в следующем разделе.
2+ -1 +1 -1 2+ -1 +1 -1 ZnCl2 + 2AgNO3 = Zn(NO3)2 + 2AgCl
В данной реакции видно, что происходит обмен одноименно заряженными ионами, например, вместо Zn+2 встает Ag+.
2+ -1 +1 2- 2+ 2- Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
В данной реакции происходит обмен между ионами OH- и SO42-.
Химические реакции могут протекать с изменением и без изменения степеней окисления. По данному признаку все реакции делятся на:
-
Реакции, протекающие без изменения степеней окисления
-
Окислительно – восстановительные реакции.
-
Без изменения степеней окисления протекают реакции между оксидами, между оксидами и водой, между оксидами и кислотами, оксидами и гидроксидами, также все реакции обмена. Например, реакция между оксидом натрия и водой:
+1 -2 +1 -2 +1 -2 +1
Na2O + H2O = 2NaOH
-
Окислительно-восстановительные реакции (ОВР) всегда протекают с изменением степеней окисления.
-
Как реагируют с кислородом щелочные ме. (тема оксиды)
Щелочные металлы при обычных условиях с кислородом образуют не оксиды, а пероксиды (перекиси), в которых кислород имеет степень окисления -1, за исключением Li, который образует с кислородом оксид.
0 0 +1 -1
2Na + O2 = Na2O2
0 0 +1 -2
4Li + O2 = 2Li2O
Пероксиды переходят в оксиды при действии на них избытка металла:
+1 -1 0 +1 -2
Na2O2 + 2Na = Na2O
Щелочноземельные металлы с кислородом образуют оксиды:
0 0 +2 -2
2Sr + O2 = 2SrO
-
Разложение нитратов (правило)
Так как все нитраты являются окислителями, то их разложение при нагревании является сложным окислительно-восстановительным процессом
Так как все нитраты являются окислителями, то их разложение при нагревании является сложным окислительно-восстановительным процессом:
+3 0
Me(NO2)x +O2↑
Ме в ряду напряжения стоит до Al
+4 0
Ме в ряду напряжения стоит от Al до Cu
+5 -2
Оксид Ме + NO2↑ + O2↑
Me(NO3)x
0 +4 0
Ме в ряду напряжения стоит после Cu
Me + NO2↑ + O2↑
+1 +5 -2 t +1 +3 -2 0
2NaNO3 = 2NaNO2 + O2↑
+2 +5 -2 t +2 -2 +4 -2 0
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
+1 +5 -2 t 0 +4 -2 0
2AgNO3 = 2Ag + 2NO2↑ + O2↑
-
Какие ионы могут одновременно существовать в растворе? Что это значит?
Одновременно могут существовать в растворе только те ионы, которые при соединении друг с другом не будут давать газ осадок воду или другое малодиссоциируещее вещество.
Например, Na+ и Cl- в растворе при соединении образуют соль NaCl, которая хорошо растворима, не является газом, поэтому эти ионы могут существовать отдельно в растворе, а например ионы H+ и СО32- при соединении образут Н2О и СО2, воду и газ, поэтому данные ионы не могут существовать вместе в растворе, так как сразу переходят в вещества, которые уже не распадаются обратно на эти ионы, то есть вода и угдекислый газ
-
Знать основные степени окисления, которые проявляют элементы с 1 по 8 группу.
Щелочные металлы +1
Щелочноземельные металлы +2
Cu +1, +2
Hg +1,+2
C -4, +2, +4
Si -4,+4
P -3,+1, +3, +5
N -3,-2,-1,+1,+2,+3,+4,+5
S -2,+2, +4, +6
Cl -1 ,+1,+2,+3,+4,+5,+6,+7
F -1
Fe +2,+3
Pb +2,+4
Mn +2,+3,+4,+5,+6,+7
Cr +2,+3,+6
O -1,-2
-
Основные сильные окислители и восстановители в неорганической химии
Сильные восстановители – NH3, H2S, K2S, K2SO3, KI, HI, СО, все металлы
Сильные окислители – KMnO4, K2Cr2O7, K2CrO4, H2SO4 (к), HNO3, KClO4, О2, О3, все галогены
-
Окраски индикаторов в разных средах
|
среда |
индикатор |
||
|
лакмус |
фенолфталеин |
метилоранж |
|
|
нейтральная |
фиолетовый |
бесцветный |
оранжевый |
|
кислая |
красный |
бесцветный |
красный |
|
щелочная |
синий |
малиновый |
желтый |
-
Какие кислоты являются сильными
HCl, HBr, HI, H2SO4, HNO3, HClO4, HClO3, H2Cr2O7, H2CrO4, HMnO4
-
Отношение галогенов к кислороду.
Галогены не реагируют с кислородом так как тоже являются сильными окислителями. Только фтор реагирует с кислородом, так как он является самым сильным окислителем.
-
Аммиак, с чем реагирует и кем является.
Аммиак NH3 является слабым основанием
-
Взаимодействие с водой
При взаимодействии с водой аммиак образует слабое основание – гидроксид аммония NH4OH, который является очень неустойчивым и способен разлагаться снова до аммиака и воды.
NH3 + H2O NH4OH
-
Взаимодействие с кислотами
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак NH3 способен также образовывать кислые соли:
NH3 + H2SO4 = NH4 HSO4
Аммиак NH3 может проявлять только восстановительные свойства, так как азот N в нем имеет низшую степень окисления –3, поэтому NH3 является сильным восстановителем.
-
Горение NH3
-3 +1 0 0 +1 -2
4NH3 + 3O2 = 2N2 + 6H2O
-
Каталитическое окисление NH3
-3 +1 0 Cr2O3 +2 -2 +1 -2
4NH3 + 5O2 = 4NO↑ + 6H2O
-
Взаимодействие с окислителями
-3 +1 +2 -2 0 0 +1 -2
2NH3 + 3CuO = 3Cu↓ + N2↑+ 3H2O
-
Взаимодействие с активными металлами
Аммиак может проявлять окислительные свойства при взаимодействии с очень активными металлами, но окислителем в нём являются не атомы азота N-3, а атомы водорода H+.
-3 +1 0 +1 -3 +1 0
2NH3 + 2Na = 2NaNH2 + H2
-
Образование аммиачных комплексных соединений
Раствор аммиака способен реагировать с гидроксидами, солями и даже оксидами d-металлов с образованием растворимых комплексных соединений:
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
-
Бурый газ, свойства, реакция с водой и щелочами
Бурый газ NO2 является кислотным оксидом, но не существует кислоты со степенью окисления азота N в ней +4, как в данном оксиде, поэтому NO2 при взаимодействии с водой образует сразу 2 кислоты, одновременно понижая и повышая свою степень окисления до +3 и +5:
+4 -2 +1 -2 +1 +3 -2 +1 +5 -2
2NO2 + H2O = HNO2 + HNO3
При взаимодействии со щелочами NO2, соответственно, образуется 2 соли
+4 -2 +1 -2 +1 +1 +3 -2 +1 +5 -2 +1 -2
2NO2 + 2KOH = KNO2 + KNO3 + H2O
-
Свойства солей аммония
Все соли аммония представляют собой белые кристаллические вещества, хорошо растворимые в воде. Все соли аммония являются сильными электролитами и способны в растворе необратимо распадаться на ионы аммония NH4+ и ионы кислотного остатка:
(NH4)2CO3 2NH4+ + CO32-
Все соли аммония способны разлагаться при нагревании:
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O
NH4Br = NH3↑ + HBr↑
Обратите внимание, что при нагревании нитрата и нитрита аммония протекает окислительно-восстановительные реакции в отличие от предыдущих:
-3 +1 +5 -2 +1 -2 +1 -2
NH4NO3 = N2O↑ + 2H2O
-3 +1 +3 -2 0 +1 -2
NH4NO2 = N2↑ + 2H2O
Соли аммония способны реагировать как с кислотами, так и с щелочами, при этом должно выполняться хотя бы одно из условий протекания обменных реакций:
(NH4)2S + 2HCl = H2S↑ + 2NH4Cl
NH4Cl + KOH = KCl + NH3↑ + H2O
По аналогичному принципу соли аммония могут реагировать с другими солями (при выпадении осадка):
2NH4I + Pb(NO3)2 = PbI2↓ + 2NH4NO3
-
Сернистый газ и серный ангидрид, свойства
-
Оксид серы (IV) имеет формулу SO2.
SO2 – сернистый газ, без цвета, имеет резкий запах, плохо растворим в воде.
Является типичным кислотным оксидом.
При растворении в воде взаимодействует с ней, образуя слабую сернистую кислоту, которая способна обратно разлагаться на воду и сернистый газ:
SO2 + H2O H2SO3
Как кислотный оксид, способен реагировать с основными и амфотерными оксидами:
SO2 + Na2O = Na2SO3
SO2 + ZnO = ZnSO3
Сернистый газ хорошо реагирует со щелочами:
SO2 + 2KOH = K2SO3 + H2O
При недостатке щёлочи возможно образование кислых солей (гидросульфитов):
SO2 + KOH = KНSO3
Так как в SO2 сера S находится в промежуточной степени окисления +4, то сернистый газ может проявлять как окислительные, так и восстановительные свойства.
Сернистый газ как восстановитель способен окисляться до более высшего оксида серы:
+4 -2 0 +6 -2
2SO2 + O2 = 2SO3
Как окислитель, SO2 способен реагировать с такими сильными восстановителями, как сероводород H2S:
+4 -2 +1 -2 0 +1 -2
SO2 + 2H2S = 3S + 2H2O
Получают сернистый газ в промышленности окисление сульфидов и серы:
+2 -2 0 +2 -2 +4 -2
2ZnS + 3O2 = 2ZnO + 2SO2
0 0 +4 -2
S + O2 = SO2
В лаборатории сернистый газ можно получить действием на сульфиты растворами сильных кислот:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
-
Оксид серы (VI) – SO3
Оксид серы (VI) также еще называют серным ангидридом. При обычных условиях SO3 – легколетучая бесцветная жидкость с неприятным запахом.
Серный ангидрид SO3 является сильным кислотным оксидом.
SO3 хорошо растворяется в воде с образованием серной кислоты:
SO3 + H2O = H2SO4
Как кислотный оксид, реагирует с основными и амфотерными оксидами:
SrO + SO3 = SrSO4
BeO + SO3 = BeSO4
Серный ангидрид хорошо реагирует с основаниями:
SO3 + 2LiOH = Li2SO4 + H2O
При недостатке щелочи возможно образование кислых солей (гидросульфатов):
SO3 + LiOH = LiНSO4
В молекуле SO3 сера S находится в максимальной степени окисления +6, поэтому может проявлять только окислительные свойства и понижать степень окисления:
+6 -2 +1 -2 +4 -2 +1 -2
3SO3 + H2S = 4SO2 + H2O
Получают SO3 в промышленности окислением SO2 при использовании катализаторов:
+4 -2 0 V2O5 +6 -2
2SO2 + O2 = 2SO3
Также SO3 можно получать при прокаливании сульфатов:
t
SnSO4 = SnO + SO3
-
Сероводород.
Сероводородная кислота образуется при растворении в воде сероводорода H2S. Сероводород H2S – газ при обычных условиях с характерным запахом тухлых яиц, токсичен, плохо растворим в воде.
Получение H2S.
-
Из простых веществ
0 0 t +1 -2
H2 + S = H2S
-
Взаимодействие сульфидов с сильными кислотами
ZnS + H2SO4 = ZnSO4 + H2S↑
Химические свойства H2S.
-
Диссоциация
H2S является слабой кислотой, поэтому плохо распадется на ионы и считается слабым электролитом.
H2S 2H+ + S2-
-
Взаимодействие с основными оксидами
H2S + CaO = CaS + H2O
-
Взаимодействие с основными гидроксидами
H2S + 2NaOH = Na2S + 2H2O
С амфотерными оксидами и гидроксидами сероводородная кислота реагирует плохо, так как все амфотерные оксиды и гидроксиды не растворимы, хорошо растворяются только в сильных кислотах, а H2S является слабой кислотой.
-
Взаимодействие с металлами
0 +1 -2 +2 -2 +1 -2
Ca + H2S = CaS + H2O
-
Взаимодействие с солями
H2S + Pb(CH3COO)2 = PbS↓ + 2CH3COOH
-
Взаимодействие с окислителями
Сера S в сероводородной кислоте H2S находится в минимальной степени окисления –2, поэтому H2S может проявлять только восстановительные свойства. H2S является сильным восстановителем, поэтому активно реагирует с окислителями.
+1 -2 +1 +6 -2 +4 -2 +1 -2
H2S + 3H2SO4 = 4SO2 + 4H2O
+1 -2 +2 -2 0 0 +1 -2
H2S + CuO = Cu + S + H2O
-
Восстановительные свойства сульфидов
Сульфиды – соли сероводородной кислоты, также являются сильными восстановителями.
+1 -2 +1 +7 -2 +1 -2 +1 +1 +6 -2 0 +1 -2 +1
Na2S + 2KMnO4 + 2KOH = 2K2MnO4 + S + 2NaOH
+1 -2 +1 -1 0 +1 -2 +1
K2S + H2O2 = S + 2KOH
-
Углекислый и угарный газ, свойства.
Оксид углерода (II) CO – угарный газ, при обычных условиях является газом без цвета и запаха, плохо растворимым в воде. Угарный газ очень ядовит, при высокой концентрации в атмосфере вызывает отравление и смерть. Угарный газ образуется при пожарах в процессе горения древесины и других органических материалов.
Угарный газ образуется при неполном горении углерода и органических веществ:
0 0 +2 -2
2С + О2 = 2СО
Угарный газ также можно получить при сжигании углерода в атмосфере углекислого газа СО2:
0 +4 -2 t +2 -2
С + СО2 = 2СО
Угарный газ СО является несолеобразующим оксидом, поэтому не реагирует с водой с образованием кислоты, не взаимодействует с основными оксидами и гидроксидами.
С точки зрения окислительно-восстановительных свойств СО является сильным восстановителем,
+2 -2 +2 -2 t 0 +4 -2
CuO + CO = Cu + CO2
+2 -2 0 +4 -2
2СО + О2 = 2СО2
При попадание в лёгкие СО связывает ионы железа в гемоглобине с образованием прочных комплексов, при этом теряется основная функция гемоглобина – перенос кислорода. Возникает кислородное голодание, которое сначала сопровождается сонливостью, потерей сознания, парализацией мышечной системы и остановкой сердца.
Оксид углерода (IV) CO2 – углекислый газ, при обычных условиях является газом без цвета и запаха, растворимым в воде, не токсичен, но при больших концентрациях в атмосфере может вызывать отравления.
Углекислый газ СО2 образуется при горении органических веществ в избытке кислорода:
-2 +1 0 +4 -2 +1 -2
С2Н4 + 3О2 = 2СО2 + 2Н2О
Получить углекислый газ также можно разложением солей карбонатов:
СаСО3 = СаО + СО2↑
СО2 является кислотным оксидом, поэтому взаимодействует с водой с образованием слабой угольной кислоты, которая способна разлагаться обратно до углекислого газа и воды:
CO2 + H2O H2CO3
Как кислотный оксид, СО2 хорошо реагирует с сильными основными оксидами и гидроксидами:
СО2 + SrO = SrCO3
СО2 + 2KOH = K2CO3 + H2O
-
Взаимодействие хлора со щелочами при нагревании и на холоде
Галогены реагируют с растворами щелочей, как правило, с образованием 2-х солей.
0 +1 -2 +1 холод +1 -1 +1 +1 -2 +1 -2
Cl2 + 2NaOH = NaCl + NaClO + H2O
0 +1 -2 +1 нагрев +1 -1 +1 +5 -2 +1 -2
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
-
Взаимодействие конц серной кислоты с галогенидами, получение газообразного хлороводорода
Если взять концентрированную серную кислоту и безводный хлорид натрия, то в условиях отсутствия воды мы получим газообразный хлороводород, и поэтому такая обменная реакция пойдет, так как выполняется условие протекания реакции ионного обмена – выделение газа
H2SO4(к) + 2NaCl = Na2SO4 + 2HCl↑
При взаимодействии NaCl с обычной разбавленной H2SO4 не образуется газ, так как HCl отлично растворяется в воде, и не выполняется ни одно из условий протекания обменных реакций, поэтому реакция не идет:
H2SO4 + 2NaCl = Na2SO4 + 2HCl
-
Перманганат калия в различных средах в реакциях ОВР
KMnO4 – сильнейший окислитель, при этом в окислительно-восстановительных реакциях в различных средах переходит в разные вещества:
+2
Mn(MnSO4)
Кислая среда (H2SO4)
+4
Водная среда (H2O)
+7
MnO2
KMnO4
+6
K2MnO4
Щелочная среда (KOH)
+1 +7 -2 +2 -2 +1 -1 +1 -1 +1 +5 -2 +2 -1 +1 -2
3KMnO4 + 5NO + 9HCl = 3KCl + 5HNO3 + 3MnCl2 + 2H2O
+1 +7 -2 +1 +6 -2 +1 -2 +1 +6 -2 +4 -2 +1 -2 +1
2KMnO4 + 3Na2SO3 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH
+1 +7 -2 +1 -1 +1 -2 +1 +1 +6 -2 0 +1 -2
2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
+1 +7 -2 +1 -1 +1 -2 +1 +1 +6 -2 +1 +6 -2 0 +1 -2
2KMnO4 + H2O2 + 2NaOH = K2MnO4 + Na2MnO4 + O2↑ + 2H2O
-
Дихромат (бихромат) и хромат калия в реакциях ОВР
K2CrO4 и K2Cr2O7 – сильнейшие окислители, хром Cr в них находится в максимальной степени окисления +6, поэтому способны реагировать с восстановителями.
В окислительно-восстановительных реакциях K2CrO4 и K2Cr2O7 в присутствии кислот переходят в соли хрома (III), образованных присутствующей кислотой:
+1 +6 -2 +1 -2 +1 -1 +1 -1 +1 +6 -2 +3 -1 +1 -2
8K2CrO4 + 3Na2S + 40HCl = 16KCl + 3Na2SO4 + 8CrCl3 + 20H2O
+1 +6 -2 -3 +1 +1 +6 -2 +1 +6 -2 +3 +6 -2 +1 +5 -2 +1 -2
4K2Cr2O7 +3NH3 + 16H2SO4 = 4K2SO4 + 4Cr2(SO4)3 + 3HNO3 + 19H2O
-
Галогенводороды. Хлор. Кислородосодержащие кислоты хлора.
Cl2 – жёлто-зеленый газ, ядовитый, растворимый в воде
Взаимодействие с металлами
Так как галогены являются сильными окислителями, то они активно реагируют с металлами – типичными восстановителями
0 0 +2 -1 Ba + Cl2 = BaCl2
Взаимодействие с неметаллами
0 0 +5 -1 2P + 5Cl2 = 2PCl5
С кислородом О2 галогены непосредственно не реагируют, так как и кислород, и галогены являются сильными окислителями, за исключением фтора F2:
0 0 +2 -1
O2 + 2F2 = 2OF2
Взаимодействие с водой
При взаимодействии с водой обычно происходит образование 2-х кислот:
0 +1 -2 +1 -1 +1 +1 -2
Cl2 + H2O = HCl + HClO
Взаимодействие со щелочами
Галогены реагируют с растворами щелочей, как правило, с образованием 2-х солей.
3Br2 + 6KOH = 5KBr + KBrO3 + 3H2O
Взаимодействие с солями бескислородных кислот
Галогены могут реагировать с солями бескилородных кислот только в том случае, если более активный неметалл (более сильный окислитель) вытеснит из соли менее активный неметалл (менее сильный окислитель)
0 +1 -2 +1 -1 0
Cl2 + Li2S = 2LiCl + S
|
Степень окисления |
+1 |
+3 |
+5 |
+7 |
|
Оксид |
Cl2O |
Cl2O3 |
Cl2O5 |
Cl2O7 |
|
Кислота |
HClO |
HClO2 |
HClO3 |
HClO4 |
|
Название кислоты |
хлорноватистая |
хлористая |
хлорноватая |
хлорная |
|
Сила кислоты |
слабая |
слабая |
сильная |
сильная |
|
Название солей, которые образует кислота |
гипохлориты |
хлориты |
хлораты |
перхлораты |
HCl – хлороводород, бесцветный газ, резкий запах, имеет соленый вкус, ядовит, хорошо растворим в воде, при этом образуя соляную кислоту
Получать можно Из простых веществ
0 0 +1 -1
H2 + Cl2 = 2HCl
-
Из солей
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
2KCl + H2SO4(к) = K2SO4 + 2HCl↑
-
Из неметаллических соединений
2PCl5 + 8H2O = 2H3PO4 + 10HCl
Химические свойства HCl
-
Взаимодействие с металлами
0 +1 -1 2+ -1 0
Zn + 2HCl = ZnCl2 + H2↑
-
Взаимодействие с основными и амфотерными оксидами
Так как соляная кислота HCl является сильной кислотой, то она способна реагировать с веществами основного и амфотерного характера.
2HCl +CuO = CuCl2 + H2O
6HCl + Fe2O3 = 2FeCl3 + 3H2O
-
Взаимодействие с основными и амфотерными гидроксидами
HCl +NaOH = NaCl + H2O
3HCl + Fe(OH)3 = FeCl3 + 3H2O
-
Взаимодействие с солями
2HBr + K2S = 2KBr + H2S↑
-
Свойства азота
Молекулы азота состоят из 2-х атомов и имеют вид N2. Азот N2 при обычных условиях является газом без цвета и запаха, нерастворимым в воде. Имеет очень низкую температуру кипения. Газ азот безвреден для нашего организма. В воздухе содержится приблизительно 70% газа азота, поэтому азот ежесекундно попадает в наш организм, не представляя для человека никакой опасности. Это связано с тем, что азот является химически инертным газом, поэтому он не слишком охотно вступает в химическое взаимодействие. Это можно объяснить наличием тройной прочной ковалентной неполярной связи между атомами азота в молекуле:
N N
Соответственно, валентность атомов азота в молекуле равна III.
Получение азота N2.
-
Промышленное получение
В промышленности азот N2 получают из воздуха путем сильного охлаждения и сжижения воздуха.
-
Лабораторное получение
Азот N2 в лаборатории можно получить разложением при нагревании таких солей, как нитрит аммония, бихромат аммония:
-3 +1 +3 -2 t 0 +1 -2
NH4NO2 = N2 + 2H2O
-3 +1 +6 -2 t 0 +3 -2 +1 -2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Химические свойства азота N2.
-
Взаимодействие с металлами
Так как азот является очень инертным веществом, то способен реагировать при обычных условиях только с очень активными металлами (щелочными и щелочноземельными), так как они являются сильными восстановителями, при этом азот будет проявлять окислительные свойства:
0 0 +1 -3
N2 + 6Li = 2Li3N
-
Взаимодействие с неметаллами
Точно также азот способен реагировать только с очень активными неметаллами (сильными окислителями), при этом он будет проявлять восстановительные свойства:
0 0 t +3 -1
N2 + 3F2 = 2NF3
С кислородом азот практически не реагирует.
Азот N2 также способен сам проявлять окислительные свойства, реагируя с наименее активными неметаллами, например, с водородом. Азот N как химический элемент сам по себе является сильноэлектроотрицательным, поэтому должен проявлять сильные окислительные свойства, но этого не происходит за счёт образования прочной тройной связи между атомами азота в молекуле.
0 0 t -3 +1
N2 + 3H2 = 2NH3
-
Свойства фосфора
Фосфор является твёрдым хрупким аморфным веществом. В обычном состоянии существует 3 аллотропные модификации фосфора: белый, красный и черный фосфор.
Белый фосфор представляет собой белое воскообразное вещество, легко режется ножом, очень легкоплавкий, плохо растворим в воде. В темноте белый фосфор светится зеленым цветом. Белый фосфор имеет молекулярную формулу Р4, имеет молекулярную кристаллическую решетку. Белый фосфор химически очень активен и чрезвычайно ядовит.
При нагревании белого фосфора при 500 0С в бескислородной среде образуется красный фосфор. Красный фосфор представляет собой твёрдое вещество пурпурного цвета, имеющее металлический блеск, более устойчив и менее химически активен, чем белый фосфор. Плохо растворим в воде. Красный фосфор не представляет большой опасности для жизни и здоровья людей.
При нагревании красного фосфора образуется чёрный фосфор. Чёрный фосфор также можно получить из белого при нагревании и высоком давлении. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, нерастворимое в воде. Чёрный фосфор еще менее активен, чем красный, является полупроводником, поэтому способен проводить электрический ток.
Получение фосфора.
-
Сплавление фосфатов с углем и песком при высокой температуре
+2 +5 -2 +4 -2 0 t +2 +4 -2 +2 -2 0
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + 2P
Химические свойства фосфора.
-
Взаимодействие с неметаллами
0 0 +5 -2
4P + 5O2 = 2P2O5
0 0 +5 -1
2P + 5Cl2 = 2PCl5
0 0 +5 -2
2P + 3S = P2S3
-
Взаимодействие с металлами
0 0 +1 -3
P + 3Na = Na3P
0 0 +2 -3
2P + 3Ca = Ca3P2
-
Взаимодействие с водой при высокой температуре
0 +1 -2 t -3 +1 +1 +5 -2
8P + 12H2O = 5PH3↑ + 3H3PO4
-
Взаимодействие с концентрированными растворами щелочей
0 +1 -2 +1 +1 -2 -3 +1 +1 +1 +1 -2
4P + 3KOH + 3H2O = PH3↑ + 3KH2PO2
-
Свойства серы.
Для элемента серы S также характерно явление аллотропии. Сера как элемент образует 3 простых вещества: ромбическая, моноклинная и пластическая сера. Наиболее устойчивая и распространенная форма – ромбическая сера S8, является твердым веществом, но имеет молекулярную кристаллическую решетку. Это хрупкое вещество желтого цвета, не растворимое в воде.
-
Взаимодействие с металлами
0 0 +1 -2
2K + S = K2S
0 0 +2 -2
Hg + S = HgS
Сера является средством против просыпанной ртути.
-
Взаимодействие с неметаллами
0 0 +4 -2
2S + C = CS2
0 0 +2 -2
S + Cl2 = SCl2
0 0 +4 -2
S + O2 = SO2
-
Взаимодействие с щелочами
0 +1 -2 +1 +1 +4 -2 +1 -2 +1 -2
3S + 6NaOH = Na2SO3 + 2Na2S + 3H2O
-
Свойства кислорода и водорода
Кислород О образует 2 простых вещества: кислород О2 и озон О3.
Озон – это газ, имеющий запах свежести. Озон О3 образуется при пропускании электрического разряда через кислород:
![]()
3О2 = 2О3
Озон – это очень сильный окислитель, в окислительно – восстановительных реакциях (ОВР) переходит в кислород О2:
SO2 + O3 = SO3 + O2
Кислород – это газ без цвета и запаха, тяжелее воздуха, не растворимый в воде.
Химические свойства кислорода.
-
Взаимодействие с металлами
Кислород способен реагировать с большинством металлов при обычных условиях с образованием оксидов:
0 0 +2 -2
2Pb + O2 = 2PbO
-
Взаимодействие с неметаллами
Как сильный окислитель, кислород реагирует со всеми неметаллами с образованием оксидов:
0 0 +4 -2
С + О2 = СО2
0 0 +5 -2
4Р + 5О2 = 2Р2О5
Только в реакции с фтором F2 кислород проявляет восстановительные свойства, так как фтор – самый сильный окислитель:
0 0 +2 -1
O2 + 2F2 = 2OF2
-
Взаимодействие с оксидами
+2 -2 0 +3 -2
4FeO + O2 = 2Fe2O3
+2 -2 0 +4 -2
2CO + O2 = 2CO2
-
Взаимодействие с бескислородными кислотами
+1 -2 0 +1 -2 0
2H2S + O2 = 2H2O + 2S
-
Взаимодействие с солями
+1 +4 -2 0 +1 +6 -2
2K2SO3 + O2 = 2K2SO4
Получение кислорода.
-
Лабораторный способ
+1 +7 -2 t +1 +6 -2 +4 -2 0
2KMnO4 = K2MnO4 + MnO2 + O2↑
+1 +5 -2 t +1 -1 0
2KClO3 = 2KCl + 3O2
-
Из пероксидов металлов и водорода
+1 -1 +1 -2 +1 -2 +1 0
2Na2O2 + 2H2O = 4NaOH + O2↑
+1 -1 MnO2 +1 -2 0
2H2O2 = 2H2O + O2↑
Молекула водорода состоит из 2-х атомов: Н2. При обычных условиях водород Н2 представляет собой газ без цвета и запаха, легче воздуха, не токсичен, очень горюч.
водород получают при пропускании водяных паров над раскаленным углем:
0 +1 -2 t +2 -2 0
С + Н2О = СО + Н2
-
Лабораторные способы
0 +1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2↑
0 +1 -2 +1 -2 +1 0
2Na + 2H2O = 2NaOH + H2↑
Химические свойства водорода.
Водород Н2 является сильным восстановителем. Окислительные свойства водород проявляет только при взаимодействии с металлами.
-
Взаимодействие с неметаллами
0 0 -3 +1
N2 + 3H2 =2NH3
0 0 +1 -1
H2 + F2 = 2HF
0 0 +1 -2
2H2 + O2 = 2H2O
-
Взаимодействие с металлами
При нагревании водород способен реагировать с щелочными металлами, проявляя окислительные свойства, так как щелочные металлы являются сильными восстановителями. Это единственный случай, когда водород Н проявляет степень окисления -1. При взаимодействии водорода с металлами образуются гидриды:
0 0 +1 -1
2Na + H2 = 2NaH
-
Взаимодействие с оксидами металлов
+2 -2 0 0 +1 -2
CuO + H2 = Cu + H2O
+2 -2 0 0 +1 -2
FeO + H2 = Fe + H2O
-
Качественные реакции на ионы. Реакции обнаружения.
Cu2+ - добавление щелочи КОН – выпадение голубого осадка Cu(OH)2
Fe2+ - добавление щелочи КОН – выпадение зеленого осадка Fe(OH)2 постепенно буреющего
Fe3+ - добавление щелочи КОН – выпадение бурого осадка Fe(OH)3
Pb2+ - добавление KI – выпадение золотистого осадка PbI2
Ag+ - добавление KCl или HCl – выпадение белого осадка AgCl, нерастворимого в кислотах
Ва2+ - добавление H2SO4 – выпадение белого осадка ВаSO4, нерастворимого в кислотах
Са2+ - добавление Na2CO3 – выпадение белого осадка СаCO3, который при добавлении кислоты растворяется и выделяется углекислый газ СО2
Zn2+ Al3+ - добавление щелочи КОН, при этом выпадает белый осадок, который растворяется при дальнейшем добавлении щелочи
NH4+ - добавление щелочи КОН – выделяется бесцветный газ аммиак NH3
SO42- - добавление BaCl2 при этом выпадает белый осадок ВаSO4, нерастворимый в кислотах
NO3- - добавление концентрированной серной кислоты, выделяется бурый газ NO2
S2- - добавление кислоты , выделяется газ с запахом тухлых яиц H2S, или добавить Pb(NO3)2, выпадет черный осадок PbS
SO32- - добавить кислоту, при этом выделиться бесцветный газ SO2
PO43- - добавить СaCl2 выпадет белый осадок Са3(РО4)2 или добавить AgNO3, выпадет желтый осадок Ag3 PO4
CO32- - добавить СaCl2 выпадение белого осадка СаCO3, который при добавлении кислоты растворяется и выделяется углекислый газ СО2
Или добавить кислоту и выделится газ СО2
SiO32- - добавить кислоту и выпадет белый осадок Н2SiO3
Cl- добавить AgNO3 выпадет белый осадок AgCl не растворимый в кислотах
Br- добавить AgNO3 выпадет желтоватый осадок AgBr не растворимый в кислотах
-
Добавить азотную кислоту, перекись водорода, перманганат калия или другой сильный окислитель, при этом выпадет фиолетовый осадок I2
-
Алканы, краткая характеристика и свойства. Метан
Алканы – это предельные углеводороды, общая молекулярная формула которых CnH2n+2
К алканам относится следующий ряд веществ (гомологический ряд):
|
Молекулярная формула |
Краткая структурная формула |
название |
|
СН4 |
СН4 |
метан |
|
С2Н6 |
СН3–СН3 |
этан |
|
С3Н8 |
СН3–СН2–СН3 |
пропан |
|
С4Н10 |
СН3–СН2–СН2–СН3 |
бутан |
|
С5Н12 |
СН3–СН2–СН2–СН2–СН3 |
пентан |
|
С6Н14 |
СН3–СН2–СН2–СН2–СН2–СН3 |
гексан |
|
С7Н16 |
СН3–СН2–СН2–СН2–СН2–СН2–СН3 |
гептан |
|
С8Н18 |
СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН3 |
октан |
|
С9Н20 |
СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН3 |
нонан |
|
С10Н22 |
СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН3 |
декан |
Метан – газ без цвета и запаха, легче воздуха, взрывоопасен, является предельным углеводородом, все связи одинарные, прочные, насыщенные,
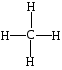
Валентность атома С во всех органических соединениях равна IV
Алканы вступают в реакции замещения с галогенами (хлором, бромом) на свету, также с азотной и серной кислотой, могут разлагаться с отщеплением водорода или разлагаться на две более мелких углеводорода (крекинг). Они не растворимы в воде, и поэтому с ней не реагируют
При горении в кислороде (на воздухе) образуют СО2 и воду
2С2Н6 + 7О2 = 4СО2 + 6Н2О
-
Алкены, краткая характеристика и свойства. Этилен
Алкены – это непредельные углеводороды, имеющие в составе одну двойную связь, общая молекулярная формула которых CnH2n
|
С2Н4 |
СН2=СН2 |
этен (этилен) |
|
С3Н6 |
СН3–СН=СН2 |
пропен (пропилен) |
|
С4Н8 |
СН3–СН2–СН=СН2 |
бутен-1 |
Они вступают в реакции присоединения с разрывом двойной связи, могут реагировать с водородом (гидрирование) с образованием алканов, с галогенами (галогенирование) – хлором, бромом (обесцвечивать бромную воду) при обычных условиях, с галогенводородами (гидрогалогенирование), с водой с образованием спиртов (гидратация), могут окисляться – обесцвечивать раствор KMnO4. Горят они также как и алканы с выделением СО2 и воды.
Этилен может всупать в реакцию полимеризации – образуя полимер полиэтилен.
Этилен – газ без цвета и запаха, легче воздуха, также взрывоопасен, является непредельным углеводородом, так как имеет двойную связь, которая в отличие от одинарных слабая и легко рвется.
-
Алкины, краткая характеристика и свойства. Ацетилен
Алкины – это непредельные углеводороды, имеющие в составе одну тройную связь, общая молекулярная формула которых CnH2n-2
|
С2Н2 |
СН≡СН |
этин (ацетилен) |
|
С3Н4 |
СН3–С≡СН |
пропин |
|
С4Н6 |
СН3–С≡С–СН3 |
бутин-2 |
Как и алкены, они вступают в реакции присоединения с разрывом тройной связи до двойной или одинарной, могут реагировать с водородом с образованием алканов, с галогенами – хлором, бромом (обесцвечивать бромную воду) при обычных условиях, с галогенводородами, с водой с образованием альдегидов и кетонов, могут окисляться – обесцвечивать раствор KMnO4. Горят они также с выделением СО2 и воды.
Алкины имеют слабые кислотные свойства, поэтому могут вступать в реакции замещения с щелочными металлами и аммиачным раствором оксида серебра
Также ацетилен может вступать в реакцию циклизации образуя бензол, и вступает в реакции полимеризации.
Ацетилен – газ без цвета и запаха, легче воздуха, взрывоопасен, является непредельным углеводородом, так как имеет тройную связь.
-
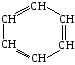
Арены, краткая характеристика и свойства. Бензол
Арены – это непредельные углеводороды, имеющие в составе бензольное кольцо.
Главным представителем аренов является бензол.
Молекулярная формула С6Н6
Структурная формула:
Общая формула - CnH2n-6
Бензол – это бесцветная нелетучая жидкость с плохим запахом, не растворяется в воде, очень токсичен, может накапливаться в организме вызывая раковые заболевания
Бензол может вступать в реакции замещения с галогенами, азотной, серной кислотой, присоединять водород, непредельные углеводороды, Горит также с выделением СО2 и воды.
-
Спирты, краткая характеристика и свойства. Этиловый спирт и метанол. Глицерин и этиленгликоль
Предельные одноатомные спирты – это органические вещества, производные алканов, имеющие в составе одну гидроксогруппу или гидроксильную группу –ОН.
Формула гомологического ряда предельных одноатомных спиртов: CnH2n+2O, или CnH2n+1OH.
Они предельные, так как не имеют двойных и тройных связей, все связи одинарные
Гомологический ряд предельных одноатомных спиртов:
|
Молекулярная формула |
Краткая структурная формула |
название |
|
СН3ОН |
СН3–ОН |
метанол, метиловый спирт |
|
С2Н5ОН |
СН3–СН2–ОН |
этанол, этиловый спирт |
|
С3Н7ОН |
СН3–СН2–СН2–ОН |
пропанол-1, пропиловый спирт |
Метанол и этанол – бесцветные и легкокипящие жидкости, между молекулами образуются водородные связи, имеют запах алкоголя.
Этанол (этиловый спирт) вызывает опьянение, в больших дозах – отравление. В организме переходит в уксусный альдегид – яд, метанол очень ядовит, и 50 мл его вызывает слепоту, а более крупная доза – смерть.
Спирты являются хорошими растворителями, хорошо смешиваются с водой.
Этанол является антисептиком, им обрабатывают раны.
Спирты обладают амфотерными свойствами, они реагируют как с кислотами – галогенводородами (HCl), азотной, серной кислотой, с карбоновыми кислотами образуют сложные эфиры; так и с активными (щелочными) металлами с выделением газа водорода. При окислении образуют альдегиды.
При сгорании на воздухе образуется СО2 и вода.
Главными представителями многоатомных спиртов являются глицерин и этиленгликоль:
этиленгликоль глицерин
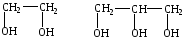
(этандиол-1,2) (пропантриол – 1,2,3)
Глицерин и этиленгликоль при обычных условиях являются бесцветными тяжелыми маслянистыми жидкостями, нелетучими, обладают низкими температурами плавления, но высокими температурами кипения. Это объясняется наличием водородных связей между молекулами многоатомных спиртов. Этиленгликоль является очень токсичным и ядовитым веществом, используется в промышленности для производства охлаждающих жидкостей (тосолов и антифризов). Глицерин, напротив, используется в пищевой промышленности, также в косметической. Глицерин входит в состав всех жиров. Глицерин – это вязкое малотекучее бесцветное гелеобразное вещество, очень сладкое на вкус.
Для глицерина и этиленгликоля характерны все те же реакции, как и для этанола и метанола, но в отличии от одноатомных спиртов они могут реагировать с Cu(OH)2, образуя ярко-синие комплексные соединения.
-
Карбоновые кислоты, краткая характеристика и свойства. Уксусная кислота
Карбоновые кислоты – это кислородосодержащие органические вещества, имеющие в составе одну или несколько карбоксильных групп:
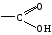
По характеру радикала карбоновые кислоты делятся на:
– предельные:
уксусная кислота
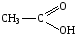
– непредельные:
акриловая кислота
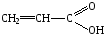
– ароматические:
бензойная кислота
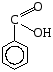
|
НСООН |
|
метановая, муравьиная кислота |
формиаты (метанаты) |
|
СН3 СООН |
|
этановая, уксусная кислота |
ацетаты (этанаты) |
Уксусная кислота является бесцветной жидкостью, летучая, с резким запахом, очень едкая, между молекулами есть водородные связи, хорошо растворяется в воде.
Уксусная кислота является органической кислотой средней силы, поэтому для нее характерны все свойства кислот, вступает в реакции замещения и обмена: реагирует с металлами, оксидами металлов, гидроксидами с образрванием солей ацетатов, также может реагировать со спиртами с образованием эфиров.
уксусная кислота ацетат натрия
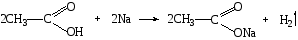
2СН3СООН + 2Na = 2CH3COONa + H2↑
2НСООН + CaO = (HCOO)2Са + H2О
2CН3СООН + Cu(OH)2 = (CH3COO)2Сu + 2H2О
Также уксусная кислота может вступать в реакции обмена с солями
2CН3СООН + Na2CO3 = 2CH3COONa + H2О + CO2↑
При сгорании на воздухе образуется СО2 и вода.
-
Аминокислоты, краткая характеристика и свойства. Глицин и аланин
Аминокислоты – это органические соединения, имеющие в составе, одновременно, одну или несколько карбоксильных групп –СООН, а также одну или несколько аминогрупп –NH2
Основные представители:
аланин
глицин
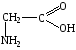
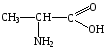
2-амино уксусная кислота
2-амино пропановая кислота
Аминокислоты имеют свойства оснований и кислот, то есть обладают амфотерными свойствами: могут реагировать как с кислотами, так и с гидроксидами и оксидами металлов, также могут образовывать внутренние соли. При взаимодействии аминокислот друг с другом образуются пептиды и белки.
-
Жиры, белки, углеводы
Жиры – это сложные эфиры, образованные глицерином и жирными кислотами.
Жиры являются основными источниками энергии для многих животных, образуя подкожные жировые клетчатки, также выполняют строительную функцию, входят в состав клеточных мембран (фосфолипиды), рпедают эластичность костям и хрящам, образуют многие гормоны, например, женский гормон астроген.
При действии щелочей на жиры образуются соли жирных кислот (мыла) и глицерин, поэтому такие реакции называют омылением жиров. Жидкие жиры содержат остатки непредельных кислот (растительные жиры), а твердые жиры содержат остатки предельных кислот (животные жиры), и при пропускании водорода жидкие жиры переходят в твердые – этот процесс называется гидрогенизация, таким образом из дешевых растительных жиров получают дорогие твердые жиры, используемые как заменители молочного жира в продуктах питания.
Таблица жирных кислот
|
Молекулярная формула |
Краткая структурная формула |
название |
характер радикала |
|
С17Н35СООН |
CH3(CH2)16COOH |
стеариновая кислота |
предельная |
|
С15Н31СООН |
CH3(CH2)14COOH |
пальмитиновая кислота |
предельная |
|
C17H33COOH |
СН3(СН2)7СН=СН(СН2)7СООН |
олеиновая кислота |
непредельная |
|
С17Н31COOH |
СН3(СН2)3-(СН2-СН=СН)2-(СН2)7-СООН |
линолевая кислота |
непредельная |
|
С17Н29COOH |
СН3-(СН2-СН=СН)3-(СН2)7-СООН |
линоленовая кислота |
непредельная |
Белки являются природными биополимерами, содержат остатки аминокислот, имеют различную структуру: линейную (первичная),спиральную (вторичная), клубочную (глобулины) – третичная.
Белки содержатся в мясе, яйцах, рыбе, бобовых, морепродуктах. При варке идет разрушение вторичной и третичной структуры – этот процесс называется денатурацией белка. Белки имеют прочную структуру, обеспечивают строительную функцию – из белков построены мышцы, из белка коллагена состоят волосы и ногти, транспортную – перенос веществ в организме, защитную – имуноглобулины и т-фаги поедают и уничтожают вирусные тела. При сжигании белков образуется запах жженых перьев.
Углеводы – это кислородосодержащие органические соединения, общая формула которых Cn(H2O)m
Простейший углевод – глюкоза С6Н12О6. Входит в состав обычного сахара, который называется сахарозой. Является белым кристаллическим веществом, хорошо растворимым в воде, без запаха, имеет сладкий вкус, имеет в составе 5 гидроксильных групп и обладает свойствами многоатомных спиртов, а также имеет альдегидную группу и обладает также свойствами альдегидов.
Поэтому может реагировать с кислотами, гидроксидом меди, щелочными металлами, аммиачным раствором оксида серебра. В твердом виде образует циклическую форму. Входит в состав многих углеводов, таких как крахмал и целлюлоза. Углеводы как правило имеют энергетическую функцию и являются источниками энергии, содержатся в овощах, фруктах, растительных продуктах, крупах. Для растений еще выполняют и строительную функцию – образуют кору, клетчатку. Горят на воздухе, образуя СО2 и воду.
Дополнительные вопросы.
-
Взаимодействие солей меди и серебра, оксида и гидроксида меди и серебра с раствором аммиака, образование комплексных соединений.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Соли меди и серебра также способны реагировать с раствором аммиака NH3 с образованием растворимых комплексных солей:
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
AgCl + 2NH3 = [Ag(NH3)2]Cl
-
Какими металлами является Be и Mg
Be – переходный металл, Mg – типичный металл, образует основные соединения
-
Взаимодействие перманганата калия и оксида марганца (4) с соляной кислотой.
+2 -2 +1 -1 +2 -1 0 +1 -2 MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
+1 +7 -2 +1 -1 +2 -1 0 +1 -1 +1 -2
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
-
Взаимодействие железной окалины с соляной кислотой и азотной кислотой, c HI
Fe3O4 является смесью двух оксидов FeO и Fe2O3 (FeO.Fe2O3), поэтому при взаимодействии с кислотами образуется 2 соли:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 проявляет, по большей части, восстановительные свойства, при этом восстановителем является именно FeO в составе магнитного железняка (Fe повышает степень окисления с +2 до +3, в итоге образуется только трёхвалентное железо):
3Fe3O4 + 28HNO3 = 9Fe(NO3)3 + NO↑ + 14H2O
Если реакция идет с сильным восстановителем таким как HI, то наоборот Fe3+ переходит Fe2+ как окислитель, а I- переходит в I2 как восстановитель
Fe3O4+ 8HI = 3FeI2 + I2 + 4H2O
-
Реакция CuCl2 и FeCl3 с KI, а также Fe2O3 и CuO с HI. (идет обмен и реакция ОВР)
KI и HI являются сильными восстановителями, а соли и оксиды Fe3+ и Cu2+ могут проявлять окислительные свойства, поэтому между этими веществами могут протекать не только обменные реакции, но еще и окислительно-восстановительные реакции, при этом ионы меди понижают заряд до с +2 до +1, а ионы железа понижают заряд с +3 до +2, йодид-ион повышает заряд с -1 до 0 и переходит в простое вещество йод – осадок черно-фиолетового цвета, в первой реакции образуется йодид меди CuI, а не хлорид как в случае с железом FeCl2 , так как йодид меди (I) является белым осадком
+2 -1 +1 0
2CuCl2 + 4KI= 2CuI + 4KCl + I2
+3 -1 +2 0
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
+2 -1 +1 0
2CuO + 4HI= 2CuI + 2H2O + I2
+3 -1 +2 0
Fe2O3 + 6HI = 2FeI2 + 3H2O + I2
-
Реакции диспропорционирования, между соединениями серы, железа, меди, хрома, углерода и т.д.
Очень часто два вещества, содержащих один и тот же элемент, но в разных степенях окисления, могут вступать между собой в реакции, при этом один элемент будет понижать, а другой повышать заряд, и оба они будут переходить в одну промежуточную степень окисления, так например, в первой реакции в SO2 сера с зарядом +4 понижает до 0 (окислитель), а в H2S сера с зарядом -2 повышает до 0, и таким образом оба вещества переходят в простое вещество серу S с зарядом ноль 0, такие реакции возможны если есть какая то промежуточная степень окисления или заряд, до которой один и тот же элемент в разных веществах может и понижать, и повышать
+4 -2 0
SO2 + 2H2S = 3S + 2H2O
+6 -2 +4
3SO3 + H2S = 4SO2 + H2O
-2 +6 +4
H2S + 3H2SO4 = 4SO2 + 4H2O
0 +6 - +4
S + H2SO4(к) = 4SO2 + 4H2O
0 +4 -2 t +2 -2
С + СО2 = 2СО
+2 -2 0 t +1 -2
CuO + Cu = Cu2O
+2 -1 0 t +1 -1
CuCl2 + Cu = CuCl
+3 -2 0 t +2 -2
Cr2O3 + 2Cr = CrO
0 +3 -1 t +2 -1
Fe + 2FeCl3 = 3FeCl2
+3 -2 0 t +2 -2
Fe2O3 + Fe = 3FeO
-
Образование слабого электролита при взаимодействии солей с сильными кислотами (без газа, осадка и воды)
Главное условие протекания ионно-обменных реакций – это образование слабого электролита – вещества, плохо распадающегося на ионы. Газ, вода или осадок являются только частным случаем слабого электролита, но слабым электролитом может быть также и слабая кислота
Na3PO4 + HCl = NaCl + H3PO4
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH
В обеих реакциях нет газа, осадка или воды, но реакции идут за счет образования слабого электролита – слабой кислоты H3PO4 и 2CH3COOH
-
Взаимодействие Si и SiO2 со щелочами, с HF.
Si + 4HF = SiF4 + 2H2
Si + 2KOH + H2O = K2SiO3 + 2H2↑
SiO2 + 4HF = SiF4↑ + 2H2O
Кремний обладает сильными восстановительными свойствами, поэтому может реагировать только с плавиковой кислотой подобно металлам
И его оксид тоже способен реагировать с ней
-
Какие неметаллы реагируют с водородом, какие нет (не могут Si и Р)
С водородом могут реагировать многие неметаллы, все галогены, кислород, азот, сера, углерод. Не могут кремний и фосфор Si и Р
-
Реакция Mg с оксидами CO2 и SiO2
Единственный случай, когда CO2 и SiO2 проявляют окислительные свойства – это реакция с магнием Mg
+2 -2 0 t +2 -2 +2 -2
CO2 + Mg = CO + MgO
+4 -2 0 t +2 -2 0
SiO2 + 2Mg = 2MgO + Si
-
Какие металлы могут реагировать с водородом (щелоч и щелочнозем)
С водородом по сути могут реагировать только самые активные металлы – щелочные и щелочно-земельные
+1 -1
Li + H2 = LiH гидрид лития
+2 -1
Ba + H2 = BaH2 гидрид бария
-
Образование кислых солей фосфорной кислоты. Реакция металлов с фосфорной кислотой
В зависимости от соотношения фосфорной кислоты или оксида фосфора могут получаться разные типы солей.
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 2KOH + Н2О = 2KН2PO4
P2O5 + 4KOH = 2K2НPO4 + H2O
H3PO4 + 3КOH = К3PO4 + 3H2O
H3PO4 + 2KOH = K2HPO4 + 2H2O
H3PO4 + KOH = KH2PO4 + H2O
Также при взаимодействии металлов с фосфорной кислотой преимущественно образуются не фосфаты, а дигидрофосфаты, так как фосфорная кислота слабый электролит диссоциирует по трем ступеням, и лучше всего диссоциация идет по первой ступени с образованием дигидрофосфат-иона H2PO4-
-
H3PO4 H+ + H2PO4-
-
H2PO4- H+ + HPO42-
-
HPO42- H+ + PO43-
2K + 2H3PO4= 2KH2PO4 + H2
-
Переход хроматов в дихроматы и наоборот. Качественные при этом признаки.
Хроматы (соли хромовой кислоты) в растворе имеют жёлтый цвет, дихроматы (соли дихромовой кислоты) – оранжевый цвет.
Из данных видов солей наибольший интерес представляют хромат калия K2CrO4 и дихромат калия K2Cr2O7.
Хроматы в кислой среде переходят в дихроматы (жёлтый цвет раствора меняется на оранжевый):
2K2CrO4 + 2HCl = 2KCl + K2Cr2O7 + H2O
Бихроматы, в свою очередь, переходят в хроматы в щелочной среде (оранжевый цвет раствора меняется на желтый):
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
-
Что такое s,p,d,f - элементы
В зависимости от того, какой подуровень является незавершенным, или на каком подуровне накапливаются электроны, все элементы делят на:
s – элементы (элементы 1,2 группы главной подгруппы)
p– элементы (элементы 3-8 группы главной подгруппы)
d– элементы (элементы всех побочных подгрупп)
f – элементы (лантаноиды и актиноиды)
-
Взаимодействие амфотерных оксидов и гидроксидов с основными оксидами и гидроксидами
Сплавление в твёрдом состоянии:
t
Al2O3 + 2KOH = 2KAlO2 + H2O
t
ZnO + 2LiOH = Li2ZnO2 + H2O
Взаимодействие в водном растворе:
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4]
ZnO + 2LiOH + H2O = Li2[Zn(OH)4]
t
Al2O3 + Na2O = 2NaAlO2
t
ZnO + BaO = BaZnO2
а) В водном растворе:
Al(OH)3 + KOH = K[Al(OH)4]
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
б) В твердом состоянии при нагревании:
t
Al(OH)3 + KOH = KAlO2 + 2H2O
t
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al2O3 и ZnO, являясь амфотерными оксидами, могут подобно кислотным оксидам при нагревании вытеснять более летучие кислотные оксиды из солей:
t
3Al2O3 + 2Na3PO4 = 6NaAlO2 + P2O5
t
ZnO + CaSO3 = CaZnO2 + SO2↑
Сконвертировано и опубликовано на https://SamoLit.com/